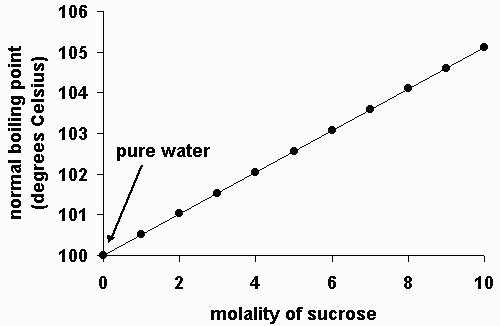
Berlawanan dengan penurunan titik beku larutan. Kenaikan titik didih larutan merupakan fenomena meningkatkan titik didih suatu pelarut disebabkan adanya zat terlarut didalam pelarut tersebut. Ini berarti bahwa titik didih pelarut akan lebih kecil jika dibandingkan dengan titik larutan. Sebagai contoh titik didih air murni adalah 100 C jika kita melarutkan gula atau garam dapur ke dalam air maka titik didihnya akan lebih dari 100 C.
Bagaimana Kita Mengukur Kenaikan Titik Didih Larutan?
Kenaikan titik didih larutan merupakan salah satu sifat koligatif larutan, Untuk menghitung perubahan titik didih larutan maka kita bisa menggunakan persamaan berikut ini:
?Tb = Kb. m . i
sedangkang titik didih larutan dicari dengan persamaan,
Tb = Tpelarut + ?Tb
dimana :
?Tb = penurunan titik beku larutan
Tb = titik beku larutan
m = molalitas larutan
Kb = konstanta titik beku pelarut
i = Faktor Van’t Hoff
Di bidang themodinamika konstanta titik beku pelarut, Kb lebih dikenal dengan istilah “Konstanta Ebulioskopik“. Ebulioskopik berasal dari bahasa Yunani yang artinya “mendidih”.
Faktor Van’t Hoff (i) adalah parameter untuk mengukur seberapa besar zat terlarut berpengaruh terhadap sifat koligatif (penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik). Faktor Van’t Hoff dihitung dari besarnya konsentrasi sesunguhnya zat terlarut yang ada di dalam larutan dibanding dengan konsentrasi zat terlarut hasil perhitungan dari massanya. Untuk zat non elektrolit maka vaktor Van’t Hoffnya adalah 1 dan nonelektrolit adalah sama dengan jumlah ion yang terbentuk didalam larutan. Faktor Van’t Hoff secara teori dapat dihitung dengan menggunakan rumus:
i = 1 + (n-1)?)
dengan ? adalah derajat ionisasi zat terlarut dan n jumlah ion yang terbentuk ketika suatu zat berada didalam larutan. Untuk non elektrolit maka alfa = o dan n adalah 1 dan untuk elektrolit dicontohkan sebagai berikut:
C6H12O6 -> C6H12O6 n = 1
NaCl -> Na+ + Cl- n = 2
CaCl2 -> Ca2+ + 2Cl- n = 3
Na3PO4 -> 3Na+ + PO4- n = 4
Cu3(PO4)2 -> 3Cu2+ + 2PO43- n = 5
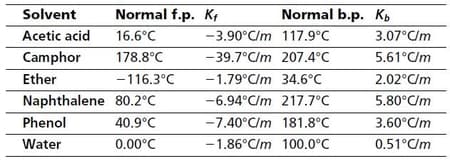
Data nilai Kf beberapa pelarut adalah sebagai berikut: